理工学部物質生命理工学科の川口眞理准教授らによる論文「Pactacin is a novel digestive enzyme in teleosts」(魚類は独自の消化システムをもっていた)が学術誌「Scientific Reports誌」に掲載されました。
川口准教授らの研究グループは、魚類の進化過程で遺伝子の重複によって新たに生じたpactacin遺伝子が魚類独自の消化酵素として働いていることを発見しました。
研究成果の概要
ヒトを含む哺乳類は胃をもち、胃で作られるペプシンなどを用いて食物を消化しています。このように私たちヒトにとって胃は重要な消化器官の1つですが、魚類には胃があるものと胃をもたない魚がいます。前者は有胃魚、後者は無胃魚と呼ばれています。有胃魚は、哺乳類と同様にペプシンを用いて消化しています。一方無胃魚は、膵臓で作られるトリプシンやキモトリプシンが消化管に分泌されて、消化管内で消化していると考えられてきました。
アスタシンファミリーと呼ばれる金属プロテアーゼファミリーの遺伝子は、遺伝子の重複により、魚類から様々な遺伝子が見つかっており、その一員には、孵化時に卵膜を分解する孵化酵素や免疫系に関わるネフロシンなどが知られています。この他にも私たちは無胃魚であるメダカには機能不明なアスタシンファミリー遺伝子があることを2006年に発表していました。
今回、メダカに加えて、同じように胃をもたないタツノオトシゴでも、この機能不明遺伝子が膵臓で発現していることを明らかにし、pactacin(pancreatic astacin)と名付けました。さらに、メダカの消化液から酵素の精製を行い、トリプシンやキモトリプシンに加えてpactacinが消化液中に主要な消化酵素として分泌されていることを明らかにしました。
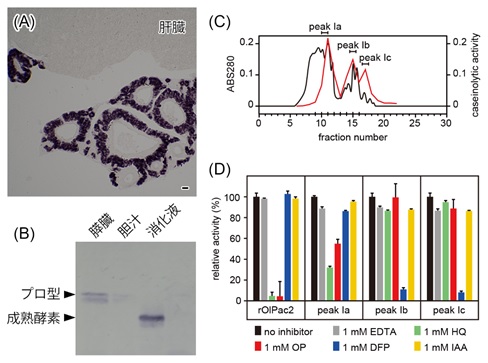
図(A)タツノオトシゴのpactacin遺伝子は膵臓で発現していた。
(B)メダカのpactacin(OlPac2)のウェスタンブロッティング。膵臓からはプロ型酵素が、消化液からは成熟酵素が検出された。
(C)HPLCを用いたメダカの消化液の部分精製。黒線がタンパク量、赤線が酵素活性を示す。活性は3つのピーク(Ia, Ib, Ic)として検出された。
(D)組換えpactacin(rOlPac2)とHPLCの3つの活性ピークの活性を、金属プロテアーゼ、セリンプロテアーゼ、システインプロテアーゼ阻害剤存在下で調べた。組換えpactacinは金属プロテアーゼでのみ活性が阻害されることがわかる。ピークIaが金属プロテアーゼ(pactacin)、IbとIcはシステインプロテアーゼ(トリプシンやキモトリプシン)と考えられる。
| 雑誌名 | Scientific Reports |
| 論文タイトル | Pactacin is a novel digestive enzyme in teleosts |
| WEBサイト | www.nature.com/articles/s41598-021-86565-9 |
| 著者 | Mari Kawaguchi, Yohei Okazawa, Aiko Imafuku, Yuko Nakano, Risa Shimizu, Reiji Ishizuka, Tianlong Jiang, Tatsuki Nagasawa, Junya Hiroi, and Shigeki Yasumasu |
- 上智大学教員教育研究情報データベース
理工学部 物質生命理工学科 川口眞理准教授